ODAC(Oncologic Drugs Advisory Committee)会议,即肿瘤药物咨询委员会会议,是美国FDA(食品和药物管理局)肿瘤审评部为特定问题而召集外部专家进行参考意见讨论的一个机制。在会议中,专家们会就药物的安全性、有效性、临床数据、研究方法等进行深入讨论,提出自己的意见和建议。通过ODAC会议,FDA能够及时了解最新的科学进展和研究成果,为药物审评提供更为科学的依据。
主要内容:CAR-T细胞治疗
针对BCMA CAR-T细胞治疗的ODAC会议已经于美国东部时间2024年3月15日8:30 AM-5:30 PM召开,会议由两部分组成:
上午议程:
Janssen Biotech公司提交的CARVYKTI(ciltacabtagene autoleucel)的补充生物制品许可申请(sBLA)125746.74。委员会将重点讨论MMY3002(CARTITUDE-4)研究中的总生存期数据,以及其在目标人群中的获益-风险。
下午议程:
Celgene Corp.(现为百时美施贵宝公司)提交的ABECMA(idecabtagene vicleucel)的sBLA 125736.218。委员会将重点讨论MM-003(KarMMa-3)研究中的总生存期数据,以及其在目标人群中的获益-风险。
尽管上述两种细胞疗法在延缓肿瘤进展方面具有巨大获益,但FDA要求肿瘤药物咨询委员会的专家们讨论研究早期总生存率的负面趋势是否“在临床获益的背景下是可接受的。经过一天的会议讨论,肿瘤药物咨询委员会专家小组以11票对0票的优势投票认为,对于那些尽管接受了初始治疗但疾病仍然持续的多发性骨髓瘤患者,强生公司和传奇生物制药开发的CAR-T药物Carvykti的获益大于其风险;同一小组以8票对3票的优势投票支持百时美施贵宝和2seventy生物公司开发的CAR-T药物Abecma展现出有利的获益风险比,包括关键的次要终点整体生存期。
在临床试验中,与标准治疗相比,两种药物都被证明能显著延缓疾病进展。但仔细观察数据,FDA发现在这两项研究的最初几个月里,死亡人数存在惊人的不平衡,CAR-T治疗组死于骨髓瘤或副作用的患者多于接受标准治疗的患者。专家组成员认为,这是一个合理的担忧,但这个担忧被CAR-T的单剂量可能帮助患者不再需要定期、繁重的癌症治疗所抵消。下面“细胞知聊”将为您带来CARVYKTI和ABECMA两个产品以及确证临床试验的简单介绍。
CARVYKTI
CARVYKTI(西达基奥仑赛)是一种BCMA CAR-T疗法,即靶向B细胞成熟抗原(BCMA)的CAR-T产品。适用于既往接受过四线及以上治疗(包括蛋白酶体抑制剂、免疫调节剂和抗CD38单抗)的复发或难治性(R/R)多发性骨髓瘤(MM)的成年患者。2022年2月经FDA批准于美国上市,该批准基于I/II期临床试验CARTITUDE-1(NCT03548207)。
CARTITUDE-4
本次会议聚焦的是CARTITUDE-4研究,FDA的主要担忧如图1所示。该试验是一项III期随机、开放标签试验(NCT04181827),并纳入对那度胺耐药的MM患者。研究共纳入419名患者,所有患者既往都接受过1~3线治疗,208名患者接受西达基奥仑赛治疗,211名患者接受医生选择治疗,主要终点为PFS,中位随访时间为15.9个月。此外,CARTITUDE-4还评估了CARVYKTI的安全性,在接受西达基奥仑赛治疗的176名患者中,134名(76.1%)出现CRS,8名(4.5%)有ICANS,1名出现运动和神经认知症状,16名(9.1%)脑神经麻痹,5名(2.8%)有CAR-T相关周围神经病变。
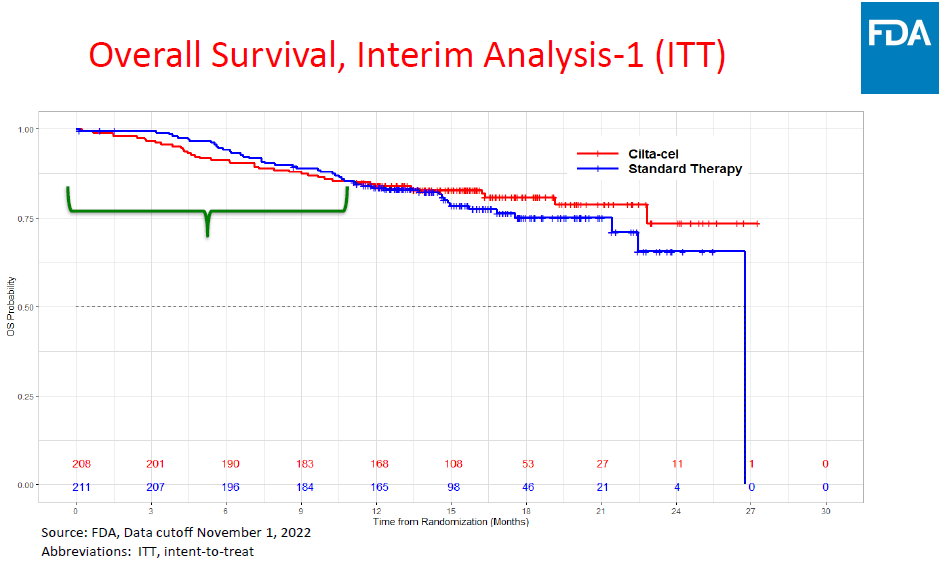
图1 不同组别患者总生存率的百分比
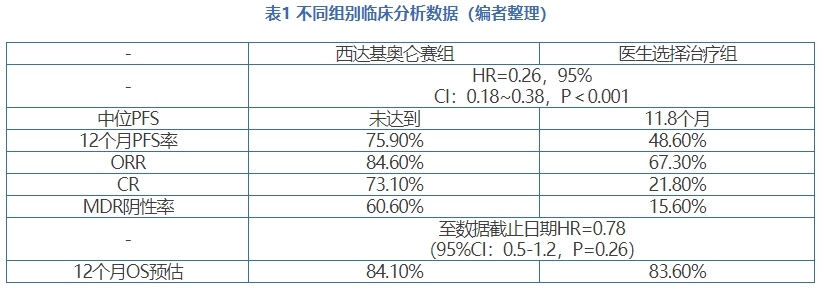
会议结果
当地时间2024年3月15日,FDA肿瘤药物咨询委员会(ODAC)基于CARTITUDE-4 III期研究的疗效和对安全性数据进行评估之后,建议CARVYKTI®(西达基奥仑赛,cilta-cel)用于治疗复发或难治性(R/R)多发性骨髓瘤(MM)成人患者,这些患者既往至少接受过一线治疗(包括一种蛋白酶体抑制剂和一种免疫调节剂)且对来那度胺耐药。委员会一致投票赞成CARVYKTI®(11比0),认为cilta-cel对拟议适应症的获益-风险评估结果良好。由CARTITUDE-4研究支持的补充生物制品许可申请(sBLA)目前正在接受FDA审查,该申请的处方药用户付费法案(PDUFA)的目标日期为2024年4月5日。
ABECMA
ABECMA也是一种BCMA CAR-T疗法。适用于既往接受过至少四线治疗(包括免疫调节剂,蛋白酶体调节剂和抗CD38单抗)的R/R MM患者。2021年3月经FDA批准于美国上市,成为首个BCMA靶向CAR-T疗法,该批准基于II期试验KarMMa(NCT03361748)。
KarMMa-3
本次会议聚焦的是KarMMa-3,FDA的主要担忧如图2所示。该试验是一项国际性、开放标签、III期临床试验,评估ABECMA与标准治疗方案在R/R MM患者中的疗效和安全性。研究共纳入386名患者,所有患者既往接受过2~4线治疗,254名接受ABECMA治疗,132名患者接受标准治疗,主要终点为PFS,关键次要终点包括ORR(PR或更好)和OS。中位随访时间18.6个月。在安全性方面,在接受ABECMA治疗的患者中,88%发生CRS,15%的患者发生了神经毒性作用。
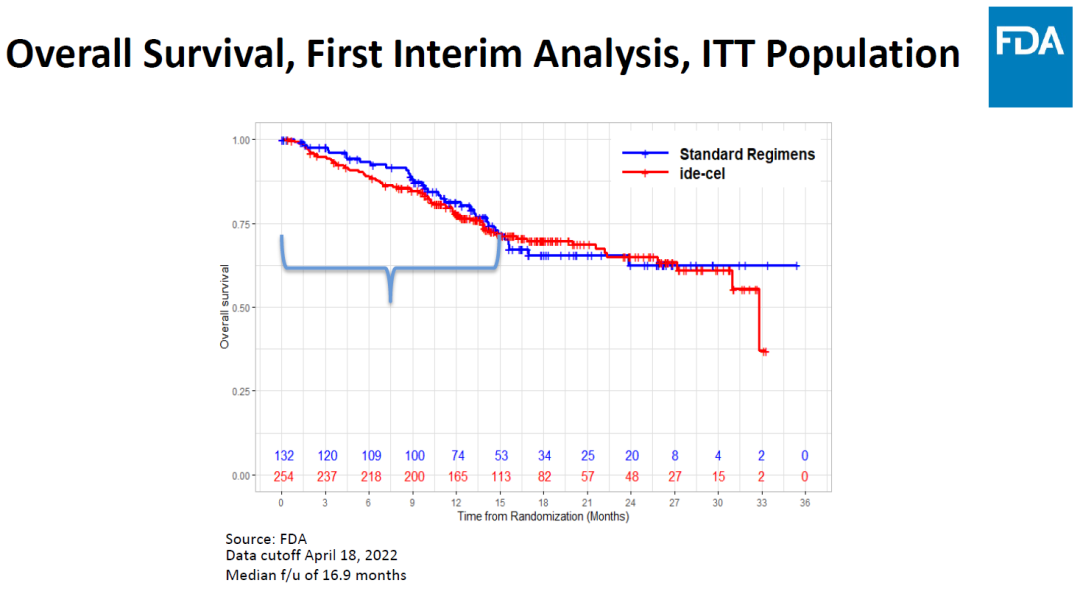
图2 不同组别患者总生存率的百分比
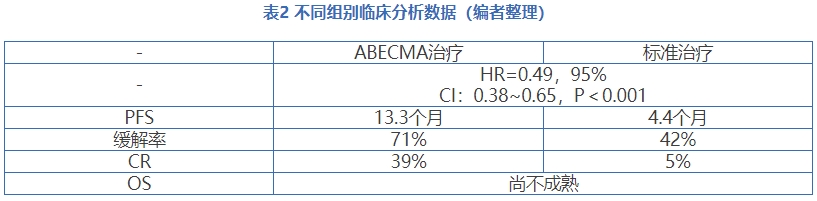
会议结果
当地时间2024年3月15日,FDA肿瘤药物咨询委员会(ODAC)针对关于Abecma的药物评审给出积极结果8:3,会议结果基于III期KarMMa-3研究,包括关键的次要终点总生存期,Abecma 显示出对三级暴露复发或难治性(R/R)多发性骨髓瘤(MM)患者具有有利的获益-风险分析。FDA在持续审查Abecma补充生物制品许可申请(sBLA)时,将充分考虑ODAC的建议,但尚未指定新的目标行动日期来审查其sBLA。
文章来源:细胞知聊-Neflibata
 loading...
loading...